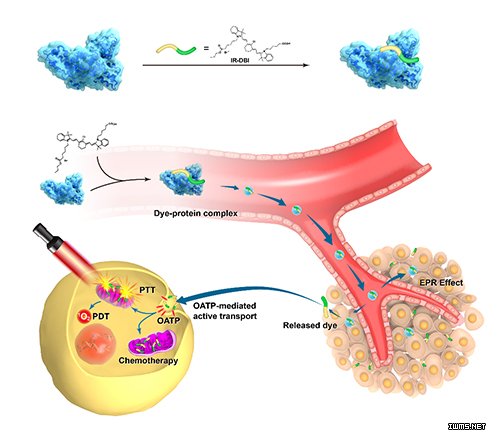
图. 多功能近红外小分子IR-DBI通过白蛋白介导的EPR效应被动运输和转运蛋白介导的主动运输双重靶向机制选择性蓄积在缺氧细胞线粒体
在国家自然科学基金项目(项目编号:81130026、81402784)等资助下,中国人民解放军第三军医大学创伤、烧伤与复合伤国家重点实验室史春梦教授研究组联合药学院和西藏军区总医院,在线粒体靶向近红外荧光小分子化合物示踪与调控缺氧细胞命运研究领域开展研究并取得重要进展,研究成果以“Structure-guided Design and Synthesis of Mitochondria-targeting Near-infrared Fluorophore with Multimodal Therapeutic Activity”(具有多重治疗活性的线粒体靶向近红外荧光团的结构引导设计与合成)为题,于2017年11月20日在Advanced Materials(《先进材料》)杂志上发表,史春梦教授为唯一通讯作者。论文链接:https://doi.org/10.1002/adma. 201704196。
细胞命运的示踪成像与靶向调控是生命科学领域的重要前沿方向,化学小分子荧光探针在分子识别方面具有独特的优势,不仅为深入研究细胞命运干预调控的分子机制提供了重要工具,还可为创新药物的发现奠定基础。线粒体广泛参与细胞代谢、信号传导、增殖、分化、凋亡和死亡等重要过程,在创伤和肿瘤等疾患的发生发展中均具有重要意义。缺氧是创伤组织和肿瘤组织细胞共有的重要病理特征,发现化学小分子靶向缺氧细胞线粒体的新机制和研发多功能线粒体靶向小分子化合物受到广泛关注和重视。
史春梦教授研究组既往在国际上报道了具有线粒体靶向特性的近红外小分子荧光探针IR-780,并在此基础上围绕IR-780及其衍生物靶向线粒体的分子机制和对细胞命运的示踪与调控开展了系列研究,发现了一种依赖HIF-1ɑ/glycolysis代谢途径及其下游特定转运蛋白主动靶向线粒体的新机制,为缺氧细胞线粒体的靶向成像与调控研究提供了新途径;进而通过构效研究和结构修饰,设计合成了系列具有调控细胞特定命运的新型活性衍生物,发现了通过调控Nrf-2信号途径增强细胞抵抗创伤微环境导致的氧化应激,实现外源性移植细胞同步示踪与保护效应的近红外小分子化合物IR-61,提出了通过线粒体靶向小分子化学修饰增强移植细胞治疗潜能的新措施,显著提高了促进组织修复与再生的效果;研究了同时具有靶向肿瘤细胞线粒体,近红外荧光成像,与光热(PTT)、光动力(PDT)及化学毒等多重杀伤效应的多功能小分子化合物IR-DBI,并发现其通过白蛋白介导的EPR效应被动转运和依赖转运蛋白主动运输进入肿瘤细胞线粒体的双重靶向机制,提出基于单一小分子化合物实现诊断治疗一体化的新理念;此外,还获得了以线粒体为靶标选择性调控细胞自噬性死亡的新化合物IR-58,并以其为探针发现抑制线粒体内膜TIM44转位酶表达,阻抑SOD2进入线粒体,增强活性氧(ROS),从而激活Akt-mTOR信号途径,诱导过度自噬的新机制,可能代表了一种新型诱导自噬性杀伤效应的小分子增强剂,并为基于细胞自噬性死亡的靶向治疗策略提供了潜在靶标。通过上述研究,发现了化学小分子靶向线粒体的一种新机制,并获得能够示踪和调控细胞命运的系列新化合物,提出了基于结构内在的多功能属性同步实现线粒体靶向、近红外成像和多重治疗活性的小分子药物研发的新策略,扩展了线粒体靶向研究新领域,可望为创伤组织修复与再生以及肿瘤的治疗提供新的思路。