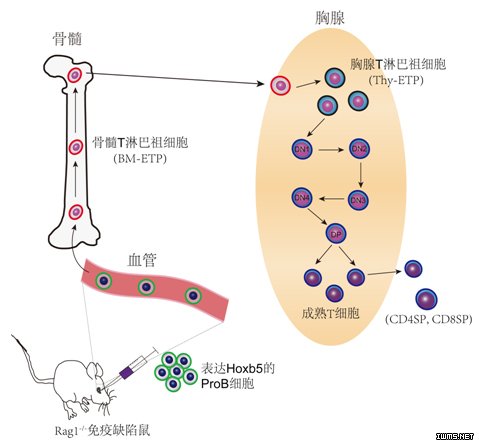
图. 过表达转录因子Hoxb5将B细胞体内重编程为T细胞示意图
在国家自然科学基金项目(项目编号:31471117,81470281,31600948,91642208,81770222)等资助下,中国科学院广州生物医药与健康研究院王金勇团队与多个团队合力攻关,避开体外无法模拟T细胞发育胸腺微环境的技术瓶颈,在国际上首次建立了一种体内重编程再生功能性T细胞的技术,并且阐明了相关重编程的细胞和表观遗传调控机制。研究成果以“Transcription Factor Hoxb5 Reprograms B Cells into Functional T lymphocytes”(转录因子Hoxb5将B细胞重编程为功能性T淋巴细胞)为题,于2018年2月12日在Nature Immunology(《自然免疫》)上在线发表。中科院广州生物医药与健康研究院研究员王金勇为文章通讯作者,博士生张梦云、董勇、胡房晓为共同第一作者。论文链接:http://dx.doi.org/10.1038/s41590-018-0046-x。
长期以来,体外再生T细胞技术面临技术困境:体外无法成功模拟T细胞发育的胸腺微环境;体外诱导产生的T细胞种类受限,而且没有经过自体胸腺微环境的阳性、阴性筛选,产生的T细胞难以在体内发挥正常、有效的生理功能。
中国科学院广州生物医药与健康研究院、吉林大学、北京大学、军事医学科学院、上海第二军医大学及福建师范大学血液及免疫学研究领域学者团队合力攻关,避开体外无法模拟T细胞发育胸腺微环境的技术瓶颈,建立了一种体内大规模功能筛选获得再生T细胞的技术平台。最终,成功地从15个候选转录因子中筛选鉴定到Hoxb5,可以在体内将B细胞重编程为T细胞。这种再生的T细胞能够在免疫缺陷鼠(缺乏T细胞)重建T免疫系统。进一步机制研究表明,Hoxb5诱导的重编程场所发生于骨髓,结束于胸腺,产生一类早期T淋巴祖细胞(ETP),之后进一步在胸腺发育成熟为CD4单阳性(CD4SP),和CD8单阳性(CD8SP) T细胞。Hoxb5通过直接靶向抑制B细胞转录因子Pax5和EBF1,上调T细胞信号通路,以及调控DNMT3a等表观调控分子实现重编程。
该研究为基础领域研究提供了认识血液谱系命运改变的新视角, 也提供了再生T细胞临床转化新思路。