在国家自然科学基金项目(项目批准号:81330058,81772473)等资助下,中山大学中山医学院黎孟枫教授课题组在细胞自噬调控非小细胞肺癌(NSCLC)发生发展的机制研究方面取得重要进展。研究成果以“CK1α Suppresses Lung Tumour Growth by Stabilizing PTEN and Inducing Autophagy”(CK1α通过稳定PTEN蛋白诱导自噬抑制肺癌生长)为题,于2018年3月28日在Nature Cell Biology(《自然·细胞生物学》)上发表, 黎孟枫教授为该文章的独立通讯作者,中山大学中山医学院蔡俊超副教授、中山大学附属第三医院研究员李荣、中山大学中山医学院博士研究生许笑南为共同第一作者。论文链接:https://www. nature.com/articles/s41556-018-0065-8。该期刊同期刊登了西班牙CIC bioGUNE生物科学协作研究中心Ivana Hermanova 和 Arkaitz Carracedo教授的述评文章 “CK1α promotes tumour suppressive autophagy”,指出“该研究解析了CK1α的抑癌作用,首次揭示了CK1α通过之前未知的AKT/FOXO3a/Atg7信号轴介导PTEN依赖性的细胞自噬,提示上述信号分子调节细胞的适应性、程序性衰老以及生命周期将是重要的研究方向”。
细胞自噬(Cellular Autophagy)是指细胞内损坏的细胞器、错误折叠的蛋白等被包裹形成囊泡,最终运送至溶酶体降解的生物学过程,是细胞维持自身稳态的重要生理机制。细胞自噬的失调与肿瘤发生关系密切,近年来如何利用细胞自噬的失调机制对肿瘤进行早期诊断和防治,如何使用自噬抑制剂作为肿瘤辅助治疗的手段,以及如何避免自噬抑制剂“误伤”抗癌的促自噬分子备受关注。
黎孟枫教授课题组发现在肺癌中表达缺失的CK1α可以作为内源性自噬诱导因子,通过激活细胞自噬抑制肺上皮细胞恶变和肺癌细胞生长。CK1α不依赖其激酶活性,主要通过与抑癌蛋白PTEN的羧基端尾直接结合,竞争性拮抗泛素化蛋白NEDD4-1对PTEN的降解和磷酸激酶对PTEN磷酸化失活的调控,从而同时上调PTEN蛋白总量和磷酸酶活性,有效阻断AKT活性,释放抑癌基因FOXO3a的转录激活作用。FOXO3a则可以直接促进新的功能性下游基因Atg7的转录表达,而Atg7在细胞自噬两条泛素化样连接系统中起至关重要的作用。该研究证实了CK1α/PTEN/FOXO3a/Atg7信号轴在保护肺上皮细胞避免发生恶变转化中的重要作用,并通过肺癌临床标本验证了CK1α/PTEN/AKT/FOXO3a/Atg7信号轴的临床相关性。
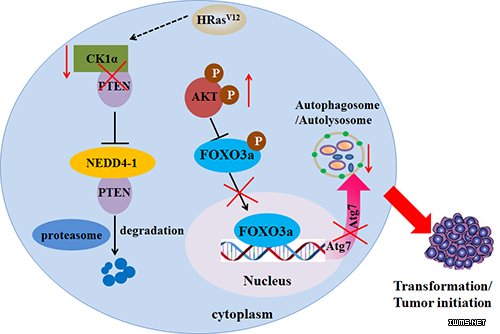
图. CK1α/PTEN/FOXO3a/Atg7信号缺失协同HRasV12促进肺上皮细胞恶变转化